君实生物PD-1二线治疗晚期神经内分泌癌3期临床启动
发布时间:2021-9-22 10:52阅读:451
(一)联合用药二线治疗启动3期临床
$和黄医药(00013)$ 今日宣布,$君实生物-U(SH688180)$ PD-1(特瑞普利单抗)+ 和黄医药索凡替尼二线治疗晚期神经内分泌癌的SURTORI-01研究3期临床启动。
首名患者已于2021 年9 月18日接受给药治疗。

SURTORI-01研究是一项开放标签、随机对照的多中心中国3期临床试验,计划招募约200名患者。研究的主要结果指标为总生存期(OS)。次要结果指标为PFS、ORR、缓解持续时间(DoR)和DCR。该研究的其他详情,请浏览clinicaltrials.gov,检索注册号NCT05015621查看。
和黄医药为SURTORI-01研究的申办人,负责该3期研究的所有临床及监管执行。和黄医药与君实生物共同为研究提供资金。
可以依据中国3期临床数据,在美国和中国申请注册适应症。
(二)神经内分泌癌vs神经内分泌瘤
神经内分泌肿瘤几乎可发生在全身的各个部位,但最常见于胃肠道、胰腺及肺部。神经内分泌癌是神经内分泌肿瘤的两种常见类型之一。通常来说在神经内分泌肿瘤中,1/3患者是分化不良、高增殖活性的为神经内分泌癌;2/3患者是分化良好、低增殖活性的为神经内分泌瘤。
(三)海外患者数量
根据 Frost & Sullivan 公司估计,2020年美国神经内分泌瘤新增病例为 1.9万例,还有14.3万名存活的神经内分泌瘤患者。[1]
基于全球流行病学趋势的分析,整个欧盟 的发病率与美国大致相近,估计2020年法国、德国、意大利、西班牙和英国约有 14万名存活的神经内分泌瘤患者。[1]
在曰本,2016年约新增0.67万例胃肠胰神经内分泌肿瘤。[2]
数据来源于
[1]根据Frost& Sullivan公司的数据,2020年美国神经内分泌瘤新诊断病例为19,000例,美国的神经内分泌瘤患者总数约为143,000名。
[2]Masui T, et al; JNETS Project Study Group. Recent epidemiology of patients withgastro-entero-pancreatic neuroendocrine neoplasms (GEP-NEN) in Japan: apopulation-based study. BMC Cancer.2020;20(1):1104. Published 2020 Nov 14. doi:10.1186/s12885-020-07581-y
(四)特瑞普利单抗+索凡替尼二线治疗晚期神经内分泌癌的2期临床数据。
2021年4月,一项单臂2期研究数据公布,旨在评估特瑞普利单抗+索凡替尼二线治疗21例一线化疗难治的晚期神经内分泌癌。
截至2020年12月31日,在20例可评估肿瘤的患者中,ORR=70%。中位PFS可达3.94个月,中位OS尚未达到。
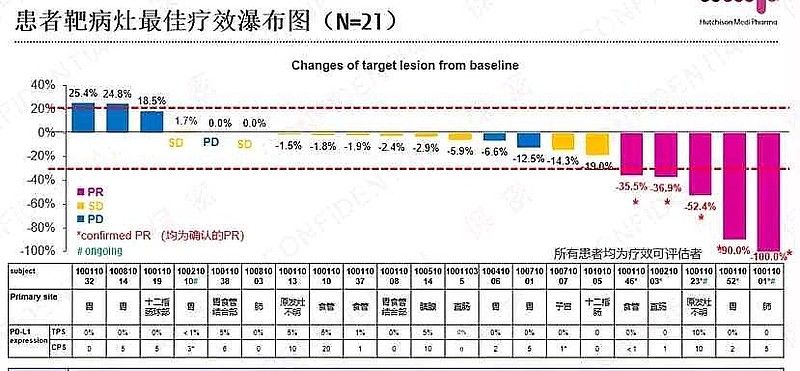
该研究亚组分析显示,无论患者PD-L1表达与否与表达高低,接受索凡替尼+特瑞普利单抗治疗均展现出良好的疗效,整体安全性良好。
特瑞普利单抗+索凡替尼二线治疗神经内分泌癌的3期临床,是开创性的。
(五)美国神经内分泌癌市场
这项3期临床试验,目标适应症应该是①支气管肺神经内分泌癌(大细胞神经内分泌癌LCNEC)②胃肠胰神经内分泌癌。
1/3神经内分泌癌是支气管肺神经内分泌癌。
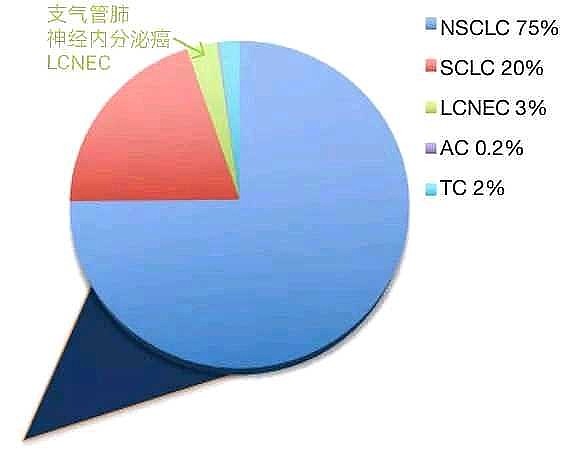
美国每年新增支气管肺癌患者23万例,按此推算,美国每年新增支气管肺神经内分泌癌0.7万例。
根据 Frost & Sullivan 公司数据推算,美国每年新增神经内分泌癌0.8万例。
$君实生物(01877)$ 特瑞普利单抗二线治疗美国晚期神经内分泌癌潜在每年市场规模=0.7万例*100万元*4个月/12个月=23亿元RMB。
(六)中国神经内分泌癌市场
中国每年新增肺癌82万例,按照3%比例计算,每年新增支气管肺神经内分泌癌(大细胞神经内分泌癌LCNEC)2.46万例。
君实生物特瑞普利单抗二线治疗中国晚期神经内分泌癌潜在每年市场规模=2.46万例*4万元*4个月/12个月=3亿元RMB。
在中国做3期临床试验,在美国上市销售赚美元,已经成为君实生物PD-1国际化进程之路
低佣股票开户入群V:442557803
低佣股票开户入群V:442557803
低佣股票开户入群V:442557803
温馨提示:投资有风险,选择需谨慎。
-
@所有人,2026春节A股/港股/港股通休市安排一览~
 2026-02-12 11:38
2026-02-12 11:38
-
开启AI炒股:华泰证券AI涨乐APP怎么使用?
 2026-02-12 11:38
2026-02-12 11:38
-
满仓没钱追新机会?一个融资融券工具轻松搞定~
 2026-02-12 11:38
2026-02-12 11:38


 问一问
问一问
 +微信
+微信
 分享该文章
分享该文章










